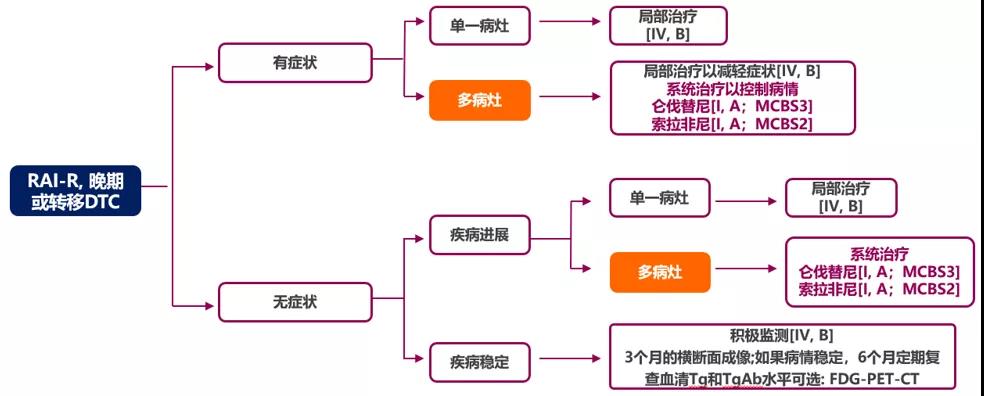
日本东京及美国新泽西州肯尼沃斯,日本卫材株式会社(总部位于东京,CEO:内藤晴夫)与MSD近日联合宣布,日本厚生劳动省(MHLW)已批准卫材株式会社研发的口服多靶点酪氨酸激酶抑制剂乐卫玛与MSD研发的抗PD-1抗体可瑞达的联合用药方案用于治疗化疗后出现疾病进展的不可切除的晚期或复发性子宫内膜癌患者。此次获批标志着乐卫玛与可瑞达的联合用药方案首次在日本获批。乐卫玛与可瑞达的联合用药方案目前已在日本、美国和欧洲获批用于治疗某些类型的晚期子宫内膜癌患者。
“在日本,子宫内膜癌的发病率每年都在稳步上升1,并且对于诊断为晚期子宫内膜癌或已出现复发的患者而言,治疗选择有限”,MSD临床研究部副总裁Gregory Lubiniecki博士说。“该联合疗法的获批使得日本的不可切除、晚期或复发性子宫内膜癌患者获得了首个基于免疫疗法与酪氨酸激酶抑制剂联合用药的治疗选择,并且这种联合疗法与化疗相比,可显著改善总生存期和无进展生存期”。
“此次是乐卫玛与可瑞达的联合用药方案首次在日本获批”,卫材株式会社高级副总裁、日本卫材株式会社总经理Terushige like说。“我们感谢那些使这项联合用药方案在日本成功获批的受试者、患者家庭和医务工作者。有了这种联合治疗方案后,我们能够非常自豪地为晚期或复发性子宫内膜癌患者提供一种额外的治疗选择”。
该联合疗法此次在日本获批基于从关键性III期研究309/KEYNOTE-775临床试验获得的结果。该临床试验结果表明,与化疗相比(研究者选择的治疗用药为多柔比星或紫杉醇),乐卫玛与可瑞达联合用药显著改善了总生存期(OS),将死亡风险降低了38%(HR=0.62 [95% CI,0.51-0.75];P<0.0001),同时显著改善了无进展生存期(PFS),将疾病进展或死亡的风险降低了44%(HR=0.56 [95% CI,0.47-0.66];P<0.0001)。乐卫玛与可瑞达联合用药治疗组的中位OS为18.3个月(95% CI,15.2-20.5),化疗治疗组为11.4个月(95% CI,10.5-12.9)。乐卫玛与可瑞达联合用药治疗组的中位PFS为7.2个月(95% CI,5.7-7.6),化疗组为3.8个月(95% CI,3.6-4.2)。
乐卫玛与可瑞达联合疗法的日本药品说明书表明,在309/KEYNOTE-775临床试验中,在接受乐卫玛与可瑞达联合用药方案治疗的406例患者(包括52例日本患者中的51例)的安全性分析集中,有395例患者(97.3%)观察到不良反应。最常见的不良反应为高血压249例(61.3%)、甲状腺功能减退222例(54.7%)、腹泻171例(42.1%)、恶心158例(38.9%)、食欲减退151例(37.2%)、疲乏113例(27.8%)、蛋白尿105例(25.9%)、呕吐98例(24.1%)、体重减轻91例(22.4%)、关节痛87例(21.4%)以及掌跖红肿综合征84例(20.7%)。
子宫内膜癌起源于子宫最内层(称为子宫内膜),该病的发病率占所有类型子宫癌的90%以上2。在日本,据估计,仅2020年即有17,000多例子宫癌新发病例,死亡病例超过3,000例。乐卫玛与可瑞达此前在日本均已各自获得用于治疗子宫内膜癌的孤儿药资格认定。
除晚期子宫内膜癌的适应症外,卫材株式会社与MSD继续在多种类型的恶性肿瘤中开发乐卫玛与可瑞达的联合用药方案,并已开展了20多项临床试验。
关于309/KEYNOTE-775临床试验
此次获批基于从研究309/KEYNOTE-775(ClinicalTrials.gov,NCT03517449)获得的数据。该研究是一项在827例(包括104例日本患者)既往至少接受过一种含铂类化疗方案的晚期子宫内膜癌患者中进行的多中心、开放性、随机和阳性对照的III期临床试验,治疗背景包括新辅助治疗和辅助治疗在内的任何背景。主要有效性结局指标为OS和PFS,由盲态独立中心审查委员会(BICR)根据RECIST v1.1标准进行评估。
所有患者以1:1的比例随机接受乐卫玛(20 mg,口服,每日一次)与可瑞达(200 mg,静脉给药,每3周给药一次)联合用药或研究者选择的治疗药物,包括多柔比星(60 mg/m2,每3周给药一次)或紫杉醇(80 mg/m2,每周一次,连续给药3周后停药1周)。患者持续接受乐卫玛与可瑞达联合用药治疗,直至出现基于实体瘤疗效评价标准(RECIST v1.1)定义的疾病进展(经BICR确认)、不可接受的毒性或可瑞达连续用药时间达到24个月的上限。如果提供治疗的研究者认为患者可获得临床获益且能够耐受治疗,则允许在出现基于RECIST定义的疾病进展后对患者给予乐卫玛和可瑞达联合用药。
关于乐卫玛 ®(仑伐替尼)胶囊
乐卫玛是由卫材株式会社研发的一款口服多激酶抑制剂,可同时抑制血管内皮生长因子(VEGF)受体VEGFR1(FLT1)、VEGFR2(KDR)和VEGFR3(FLT4)的激酶活性。除正常细胞功能外,乐卫玛还可抑制与病理性血管生成、肿瘤生长和恶性肿瘤进展相关的其他激酶,包括成纤维细胞生长因子(FGF)受体FGFR1-4、血小板衍生生长因子受体α(PDGFRα)、KIT和RET。在同系小鼠肿瘤模型中,与任一药物单独用药相比,乐卫玛与抗PD-1单克隆抗体联合用药可减少肿瘤相关巨噬细胞的数量,增加活化的细胞毒性T细胞数量,并显示出更强的抗肿瘤活性。
目前,乐卫玛已在超过75个国家(包括日本、中国、欧洲和亚洲的部分国家)获批用于单药治疗甲状腺癌,并在美国获批用于单药治疗局部复发性或转移性、进展性和放射性碘难治性分化型甲状腺癌。此外,乐卫玛已在日本、欧洲、中国和亚洲等70多个国家获批用于单药治疗不可切除的肝细胞癌,在美国获批用于一线治疗不可切除的肝细胞癌。乐卫玛还在日本获批用于单药治疗不可切除的胸腺癌。乐卫玛与依维莫司联合用药已在60多个国家(包括欧洲和亚洲)获批用于治疗既往接受过抗血管生成药物治疗后的肾细胞癌患者,以及在美国获批用于治疗既往接受过一种抗血管生成药物治疗后的晚期肾细胞癌成年患者。在欧洲,乐卫玛以商品名Kisplyx® 上市,用于治疗肾细胞癌。在美国和欧洲,乐卫玛已获批与可瑞达(通用名:帕博利珠单抗)联合用药用于一线治疗晚期肾细胞癌(RCC)成人患者。在美国,乐卫玛已获批与可瑞达联合用药用于治疗在任何背景下在既往接受过全身治疗后出现疾病进展、不适合根治性手术或放疗的非微卫星高度不稳定(MSI-H)或错配修复缺陷型(dMMR)的晚期子宫内膜癌患者;在加拿大和澳大利亚等10多个国家,该联合用药方案已获批用于治疗类似的适应症(包括有条件批准)。在一些地区,该适应症能否进一步获批取决于各项确证性临床试验中对临床获益的验证和描述。在欧洲,乐卫玛已获批与可瑞达(通用名:帕博利珠单抗)联合用药用于治疗既往接受含铂类化疗期间或化疗后出现疾病进展且不适合接受根治性手术或放疗的晚期或复发性子宫内膜癌成人患者。在日本,该药已获批与可瑞达(通用名:帕博利珠单抗)联合用药,用于治疗因恶性肿瘤接受化疗后出现疾病进展的不可切除的晚期或复发性子宫内膜癌患者。
关于可瑞达®(帕博利珠单抗)注射液,100 mg
可瑞达是一种抗程序性死亡受体-1(PD-1)治疗药物,其通过增强人体免疫系统帮助监测和杀灭肿瘤细胞的能力而发挥作用。可瑞达是一种人源化单克隆抗体,可阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞。
MSD目前正在进行行业内规模最大的免疫肿瘤领域的临床研究项目。目前已开展了1,600多项临床试验,在多种恶性肿瘤和治疗背景中对可瑞达进行评价。可瑞达临床项目旨在了解可瑞达对多种恶性肿瘤的抑制作用以及可能预测患者从可瑞达治疗中获得临床获益可能性的因素,包括探索几种不同的生物标志物。